
Sửa Đổi USP <797> và Tác Động
-
Hãng sản xuất: Particle Measuring Systems - Mỹ Model: Document: -
Liên hệ
Sửa Đổi USP <797> và Tác Động

1- Giới Thiệu
Trong bối cảnh các tiêu chuẩn dược phẩm, Dược điển Hoa Kỳ (USP) đóng vai trò quan trọng trong việc thiết lập tiêu chuẩn cho danh tính, chất lượng, độ tinh khiết và sức mạnh của thuốc, thành phần thực phẩm và thực phẩm bổ sung. Khi công nghệ và y học tiến bộ, các tiêu chuẩn bảo vệ sức khỏe và phúc lợi cũng phát triển theo. Bản sửa đổi USP 797 mới nhất mang lại những thay đổi chạm đến nhiều khía cạnh của thực hành dược phẩm. Trong bài viết blog này, chúng ta sẽ khám phá Quy trình Phát triển Tiêu chuẩn Quy định của USP.
Hiểu Quy trình Phát triển Tiêu chuẩn Quy định của USP
Trước khi đi vào các thay đổi cụ thể, điều cần thiết là nắm bắt quy trình mà các tiêu chuẩn USP được phát triển. Quy trình Phát triển Tiêu chuẩn Quy định của USP theo dõi một chuỗi các bước, bắt đầu từ việc xác định nhu cầu sức khỏe cộng đồng. Một khi xác định, một tiêu chuẩn dự thảo được tạo ra, mở cửa cho một giai đoạn bình luận công cộng. Sau khi xem xét kỹ lưỡng và phê duyệt, tiêu chuẩn được công bố. Quy trình hợp tác này bao gồm các nhà sản xuất, ủy ban chuyên gia bao gồm các chuyên gia ngành, nhà cung cấp dịch vụ chăm sóc sức khỏe, học viện và đại diện chính phủ, tất cả cùng làm việc để đảm bảo chất lượng cao nhất trong các tiêu chuẩn ngành.
USP <797> là gì?
USP <797> là một bộ hướng dẫn do Dược điển Hoa Kỳ phát triển để đảm bảo việc xử lý, chuẩn bị và sử dụng thuốc vô trùng một cách an toàn. Những hướng dẫn này có thể áp dụng cho tất cả các cơ sở chăm sóc sức khỏe nơi thực hiện pha chế thuốc, bao gồm các hiệu thuốc bệnh viện, cơ sở pha chế 503A và 503B, các hiệu thuốc pha chế Thú y trong các Bệnh viện Thú y, các chương trình giáo dục của Trường Cao đẳng Dược, v.v.
USP <797> bao gồm nhiều quy trình và thực hành khác nhau, từ thiết kế và bảo trì khu vực phức hợp đến đào tạo và năng lực của nhân viên. Nó cũng bao gồm các hướng dẫn về giám sát môi trường, đảm bảo chất lượng và kiểm tra, cũng như tài liệu và lưu giữ hồ sơ. Bằng cách cung cấp một khuôn khổ toàn diện cho việc bào chế thuốc vô trùng, USP <797> đóng vai trò quan trọng trong việc bảo vệ sự an toàn của bệnh nhân, tiêu chuẩn hóa các thực hành và đảm bảo tuân thủ các cơ quan quản lý.
II-Những Điểm Sửa Đổi Chính trong Bản Cập Nhật USP 797 Mới Nhất
Bản sửa đổi USP 797 mới nhất bao gồm một loạt các khu vực quan trọng trong thực hành dược phẩm. Hãy khám phá một số khía cạnh chính được nêu bật trong bản cập nhật toàn diện này:
- Chuẩn bị Chế Phẩm Dạng Vô Trùng: Bản sửa đổi đề cập đến các tiêu chuẩn liên quan đến việc pha chế các chế phẩm vô trùng, nhấn mạnh an toàn và chất lượng trong quy trình sản xuất.
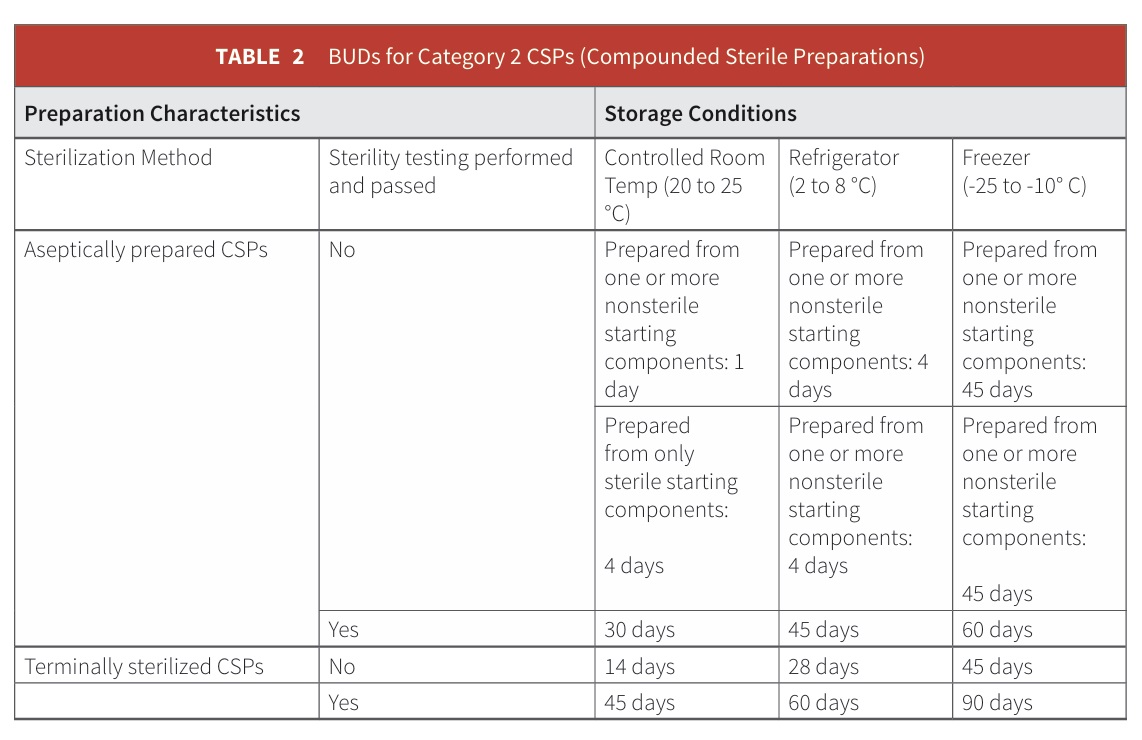
- Yêu Cầu Ngày Sử Dụng: Có những cập nhật đối với yêu cầu xác định Ngày Sử Dụng, đảm bảo rằng các sản phẩm dược phẩm giữ được tính toàn vẹn và hiệu quả cho thời gian dự định.
- Tiệt Trùng Cuối Cùng: Những thay đổi trong tiêu chuẩn cho các quy trình tiệt trùng cuối cùng nhằm tăng cường an toàn và hiệu quả của các quy trình tiệt trùng trong sản xuất dược phẩm.
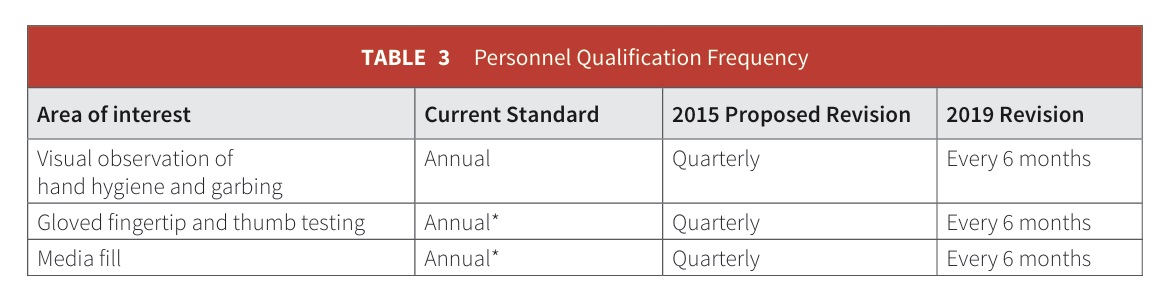
- Điều Kiện Làm Việc của Nhân Viên: Bản sửa đổi nhấn mạnh tầm quan trọng của việc đánh giá nhân viên, đảm bảo rằng cá nhân tham gia vào quy trình dược phẩm đáp ứng các tiêu chuẩn năng lực cần thiết.
- Hiệu Chuẩn, Chứng Nhận, và Đánh Giá: Yêu cầu nghiêm ngặt cho việc hiệu chuẩn, chứng nhận, và đánh giá thiết bị và quy trình đã được đề ra để duy trì độ chính xác và chuẩn xác.
- Yêu Cầu Cơ Sở: Cập nhật trong yêu cầu cơ sở góp phần duy trì một môi trường vô trùng và kiểm soát, quan trọng cho hoạt động dược phẩm.
- Yêu Cầu Chứng Nhận của Phòng Sạch Được Phân Loại: Bản sửa đổi đề ra các yêu cầu chứng nhận cụ thể cho các phòng sạch được phân loại, phù hợp với cam kết về chất lượng và an toàn của ngành.
- Chất Lượng và Kiểm Soát Môi Trường: Cải thiện trong các tiêu chuẩn liên quan đến chất lượng và kiểm soát môi trường góp phần vào toàn vẹn tổng thể của các quy trình dược phẩm.
- Đánh Giá Rủi Ro Vi Sinh vật Trong Không Khí và Bề Mặt: Cập nhật USP 797 bao gồm hướng dẫn cho việc đánh giá rủi ro vi sinh vật trong không khí và bề mặt, nhấn mạnh các biện pháp chủ động để xác định và giảm thiểu rủi ro tiềm năng.
- Giám Sát Vi Sinh vật Trong Không Khí và Bề Mặt: Các tiêu chuẩn cung cấp sự rõ ràng về việc giám sát vi sinh vật trong không khí và bề mặt, đảm bảo một cách tiếp cận toàn diện đối với bảo đảm chất lượng.
Nền Tảng Quy Định
Dược điển Hoa Kỳ (USP) là một tổ chức phi lợi nhuận về khoa học đặt ra các tiêu chuẩn được sử dụng trên toàn thế giới đối với danh tính, chất lượng, độ tinh khiết và sức mạnh của thuốc, thành phần thực phẩm và thực phẩm bổ sung. Sứ mệnh của tổ chức này là cải thiện sức khỏe toàn cầu thông qua các tiêu chuẩn công cộng và các chương trình liên quan giúp đảm bảo chất lượng, an toàn và lợi ích của thuốc và thực phẩm. Với sự tiến bộ của công nghệ và y học, các tiêu chuẩn mới được tạo ra để đảm bảo sức khỏe và phúc lợi của công chúng. Quy trình như sau:
Bảng 1 Quy Trình Phát Triển Tiêu Chuẩn Quy Định
- Nhu Cầu Sức Khỏe Công Cộng
- Dự Thảo Tiêu Chuẩn
- Giai Đoạn Bình Luận Công Cộng
- Xem Xét và Phê Duyệt
- Công Bố

Việc phát triển bản mô tả USP và Tiêu Chuẩn Tham Chiếu chính thức là một quy trình hợp tác giữa USP, các nhà sản xuất và các ủy ban chuyên gia bao gồm các chuyên gia tình nguyện từ ngành công nghiệp, nhà cung cấp dịch vụ chăm sóc sức khỏe, học viện và chính phủ. USP áp dụng một cách tiếp cận hợp tác và nghiêm ngặt để đảm bảo Tiêu Chuẩn Tham Chiếu USP phản ánh chất lượng cao nhất trong ngành, bởi vì giúp các công ty tuân thủ các yêu cầu chất lượng là một trong những mục tiêu chính của họ.
Tiệt Trùng Cuối Cùng: Như được chỉ ra trong bảng trên, các CSP được tiệt trùng trong hệ thống bao bì-đóng gói cuối cùng của chúng (tiệt trùng cuối cùng) được phép có ngày sử dụng lâu hơn so với CSP được tiệt trùng qua lọc.
Bản sửa đổi đã công bố rõ ràng rằng "tiệt trùng cuối cùng (ví dụ: nhiệt khô, hơi nước, hoặc bức xạ) là phương pháp ưu tiên trừ khi CSP cụ thể hoặc hệ thống bao bì-đóng gói không chịu được tiệt trùng cuối cùng." Điều này khác với tiêu chuẩn trước đây, chỉ yêu cầu rằng "phương pháp tiệt trùng được chọn cả tiệt trùng và duy trì sức mạnh, độ tinh khiết, chất lượng, và tính toàn vẹn của bao bì CSP."
Điều Kiện Làm Việc của Nhân Viên: USP <797> yêu cầu:
- Chỉ định một người để giám sát và đánh giá nhân viên pha chế.
- Đào tạo và kiểm tra về nguyên tắc và thủ tục cho nhân viên mới và đánh giá hàng năm cho những người khác về pha chế vô trùng, mặc quần áo bảo hộ, vệ sinh, lấy mẫu đầu ngón tay và ngón cái đã găng tay và kiểm tra đổ đầy môi trường.
- Yêu cầu về trang phục bảo hộ: Đảm bảo rằng nhân viên pha chế mặc găng tay vô trùng không bột, trang phục tay dài không bằng cotton, ít xơ vải, co ở cổ tay và đóng kín ở cổ; khẩu trang và phủ bảo hộ dùng một lần cho đầu và lông mặt.
Đào Tạo và Đánh Giá Nhân Viên Trong Thao Tác Vô Trùng: USP yêu cầu:
- Yêu cầu mạnh mẽ hơn đối với "chuyên gia".
- Kỳ thi hàng năm.
- Phân tích định tính (quan sát) và/hoặc định lượng (kiểm tra độ mạnh) cho việc đánh giá nhân viên.
Hiệu Chuẩn, Chứng Nhận và Đánh Giá: Sửa đổi cũng đặt nhiều trọng tâm hơn vào việc hiệu chuẩn, chứng nhận và đánh giá thường xuyên của thiết bị và khu vực được phân loại. Ví dụ, chương sửa đổi yêu cầu rõ ràng việc chứng nhận hoặc hiệu chuẩn của thiết bị theo dõi nhiệt độ và áp suất, lò nhiệt khô, và lò ấp trên cơ sở liên tục. Ngoài ra, bản sửa đổi đã công bố yêu cầu rằng các máy ghi biểu đồ đã được hiệu chuẩn phải được sử dụng để theo dõi mỗi chu trình cho việc tiệt trùng và loại bỏ pyrogen trong autoclaves và lò nhiệt khô.
Yêu Cầu Cơ Sở: Các tham số sau được thực thi:
- Độ ẩm dưới 60%.
- Nhiệt độ 20 độ C hoặc mát hơn.
- Phân chia rõ ràng giữa "phòng" và "khu vực".
- Giới thiệu thuật ngữ "suite phòng sạch".
- Bố trí bộ lọc HEPA cho cả phòng chờ và phòng đệm phải ở trên trần.
- Lỗ thông hơi thấp trên tường trừ khi được xác nhận khác qua nghiên cứu khói.
- Yêu cầu tối thiểu 20 lần thay đổi không khí mỗi giờ (ACPH) trong khu vực ISO 8.
Yêu Cầu Chứng Nhận Của Phòng Sạch Được Phân Loại: Đối với việc chứng nhận phòng sạch được phân loại, kiểm tra dòng không khí để xác định vận tốc và khối lượng không khí, tốc độ trao đổi không khí, và áp lực phòng là yêu cầu cần thiết. Báo cáo chứng nhận cơ sở phải ghi rõ số lần thay đổi không khí mỗi giờ (ACPH) được cung cấp bởi hệ thống HVAC, ACPH được cung cấp bởi kiểm soát kỹ thuật chính và tổng ACPH. Các yêu cầu khác bao gồm kiểm tra rò rỉ tính toàn vẹn của bộ lọc HEPA, đếm tổng số hạt, và nghiên cứu mô phỏng khói để chứng minh dòng không khí một chiều.
Kiểm Tra và Điều Kiện Hoạt Động của Cơ Sở: Bản sửa đổi đã công bố nhấn mạnh rằng tất cả các kiểm tra thực hiện như một phần của việc chứng nhận cơ sở phải được thực hiện dưới điều kiện hoạt động động (tức là điều kiện hoạt động bình thường với sự hiện diện của nhân viên trong phòng sạch).
Chất Lượng và Kiểm Soát Môi Trường: Các khuyến nghị và yêu cầu về lấy mẫu môi trường hữu sinh và không hữu sinh bao gồm những điều sau:
- Mô tả bản chất và tần suất kiểm tra vi sinh vật hữu sinh và tổng số hạt.
- Ít nhất một lần lấy mẫu hữu sinh hàng tháng dựa trên đánh giá rủi ro (tần suất có thể cao hơn).
- Đề cập đến phản ứng thích hợp với kết quả tích cực và xu hướng.
- Yêu cầu làm sạch trước khi bắt đầu và kết thúc mỗi phiên làm việc.
- Giặt hàng ngày cho áo choàng tái sử dụng để đảm bảo tất cả phù hợp cho sử dụng trong phòng sạch (không rụng xơ).
- Làm rõ yêu cầu vệ sinh cho tất cả các khu vực bao gồm khu vực pha chế vô trùng.
- Đề cập đến tần suất giám sát môi trường dựa trên quy mô và số lượng nhân viên.
- Liệt kê các Quy trình Vận Hành Chuẩn (SOP) cần thiết.
Đánh Giá Rủi Ro Vi Sinh vật Trong Không Khí và Bề Mặt: Một chương trình giám sát vi sinh vật trong không khí và bề mặt hiệu quả cung cấp thông tin về chất lượng môi trường của khu vực pha chế. Ngoài ra, một chương trình giám sát vi sinh vật trong không khí và bề mặt hiệu quả cũng xác định xu hướng chất lượng môi trường theo thời gian, xác định các con đường ô nhiễm tiềm năng và cho phép thực hiện các hành động khắc phục để giảm thiểu rủi ro ô nhiễm CSP.
Như một phần của những yêu cầu này, một chương trình lấy mẫu và kiểm tra vi sinh vật mạnh mẽ nên bao gồm việc đánh giá rủi ro chính thức để xác định nơi trong quy trình có rủi ro đối với sản phẩm hoặc bệnh nhân. Để thực hiện một đánh giá rủi ro kỹ lưỡng, điều quan trọng là phải hiểu rõ mọi chi tiết về sản phẩm và quy trình và xác định nơi có khả năng tiếp xúc với

Giám Sát Vi Sinh Vật Trong Không Khí và Bề Mặt: Lấy mẫu không khí hoạt động thể tích sử dụng thiết bị va đập phải được thực hiện trong mỗi khu vực được phân loại [ví dụ: PEC lớp ISO 5 và phòng (các phòng) lớp ISO 7 và 8] trong điều kiện hoạt động động ít nhất mỗi 6 tháng. Điểm lấy mẫu không khí phải được chọn trong tất cả các khu vực được phân loại.
Lấy mẫu bề mặt trong tất cả các khu vực được phân loại và các phòng chuyển qua kết nối với các khu vực được phân loại về ô nhiễm vi sinh vật phải được thực hiện ít nhất hàng tháng.
Mỗi khu vực được phân loại phải được lấy mẫu, bao gồm các điểm sau:
- Bên trong PEC và thiết bị chứa trong đó.
- Khu vực sắp xếp hoặc làm việc gần PEC.
- Bề mặt thường xuyên chạm vào.
GIÁM SÁT BỀ MẶT VỚI HỆ THỐNG SURCAPT® VÀ GREENLIGHT® VI SINH:

III-Kết Luận
Những thay đổi trong USP <797> là để đáp ứng nhu cầu của một ngành công nghiệp đang thay đổi nhằm đảm bảo các tiêu chuẩn chất lượng được đáp ứng và thực thi bằng cách ngăn chặn các con đường ô nhiễm vi sinh vật. Ngày Sử Dụng và tiệt trùng cuối cùng cho CSP, điều kiện làm việc của nhân viên, chứng nhận phòng sạch và giám sát vi sinh vật trong không khí và bề mặt đều đã bị ảnh hưởng bởi những thay đổi trong tiêu chuẩn.
Để chuyển sang các yêu cầu mới, điều quan trọng là phải hiểu rõ quy trình của bạn và các khu vực rủi ro. Chương trình giám sát bạn chọn nên bắt đầu với một đánh giá rủi ro chính thức để xác định những rủi ro tiềm ẩn đối với sản phẩm hoặc bệnh nhân. Việc hiểu cách tất cả các thành phần quy trình kết nối với nhau là cần thiết để đảm bảo yêu cầu quy định được đáp ứng và chất lượng cao của sản phẩm cuối cùng được chứng minh.
Để biết thêm thông tin về dịch vụ tư vấn từ Hệ thống Đo Lường Hạt, bao gồm đánh giá rủi ro, hãy truy cập tại https://www.pmeasuring.com/service-and-support/consultancy-training/.
Giải Pháp Giúp Bạn Đáp Ứng Yêu Cầu Giám Sát Môi Trường USP <797> Dược sĩ pha chế, học cách đáp ứng nhanh chóng và dễ dàng USP <797> với các giải pháp đã được chứng minh. Các chuyên gia của chúng tôi theo dõi tất cả các yêu cầu quy định và thiết kế các sản phẩm hiệu quả để giúp bạn dễ dàng thực hiện công việc của mình trong khi đáp ứng các quy định. Chìa khóa để giải quyết vấn đề 503s bao gồm Đếm Hạt và Giám Sát Hữu Sinh / Vi Sinh vật, và Hệ thống Đo Lường Hạt (PMS) cung cấp cả hai với các giải pháp quản lý dữ liệu và dịch vụ tư vấn.
GIẢI PHÁP GIÁM SÁT HỮU SINH: Máy Lấy Mẫu Không Khí Di Động: MiniCapt® PMS cung cấp máy lấy mẫu không khí hoạt động cho 3 tốc độ dòng khác nhau (25 LPM, 50 LPM và 100 LPM) cho nhiều lượng phủ sóng. Chúng tôi cũng cung cấp máy lấy mẫu không khí cơ bản MiniCapt Mobile EL có thể được sử dụng cho các ứng dụng không vô trùng.
Thay Thế Đĩa Định Khuẩn: BioCapt® Single-Use Impactor Những đĩa này đã được đổ đầy sẵn là một lựa chọn dùng một lần, sẵn sàng sử dụng cho việc lấy mẫu không khí hoạt động mà không cần autoclave. Lợi ích tốt nhất được thấy với nguồn hút chân không 50 LPM hoặc ít hơn. Lý tưởng khi sử dụng với MiniCapt Mobile.
GIẢI PHÁP GIÁM SÁT HẠT (KHÔNG HỮU SINH): Máy Đếm Hạt: Lasair® III Đặt tiêu chuẩn cho máy đếm hạt aerosol di động, Lasair III cũng là máy giám sát liên tục và từ xa lý tưởng. Đảm bảo môi trường của bạn sạch sẽ với phạm vi cảm biến của thiết bị từ 0.3 - 25.0 µm.
GIẢI PHÁP QUẢN LÝ DỮ LIỆU: Phần Mềm DataAnalyst Quản lý và hiểu dữ liệu từ các thiết bị giám sát ô nhiễm của bạn bằng cách sử dụng Phần Mềm DataAnalyst. DataAnalyst là một cách dễ dàng, tiết kiệm chi phí để quản lý dữ liệu và duy trì hồ sơ điện tử. Nó biết cần tìm gì và thực hiện các tính toán cho bạn. Tải xuống, lưu trữ và báo cáo dữ liệu dễ dàng trong khi đáp ứng đầy đủ các yêu cầu chuyển giao dữ liệu bảo mật.
Giải Pháp Giám Sát Môi Trường cho 503B Lớn Chúng tôi có thể kết hợp máy đếm hạt của mình với Bộ Xử Lý FacilityPro® cho các hệ thống giám sát liên tục lớn hơn. Bao gồm cảnh báo và tự động hóa công nghiệp để đảm bảo độ tin cậy của hệ thống của bạn.
DỊCH VỤ TƯ VẤN Chúng tôi có một đội ngũ chuyên gia đến cơ sở của bạn và giúp bạn cải thiện quy trình, đào tạo đội ngũ của bạn và tư vấn về một giải pháp giám sát hiệu quả để đáp ứng nhu cầu của bạn.
- Cam kết chất lượng
- Bảo hành chính hãng
- Giao hàng tận nơi
- DỊCH VỤ 24/7
 SAO NAM - ĐẠI LÝ CHÍNH HÃNG CỦA PARTICLE MEASURING SYSTEMS TẠI VIỆT NAM
SAO NAM - ĐẠI LÝ CHÍNH HÃNG CỦA PARTICLE MEASURING SYSTEMS TẠI VIỆT NAM




_-02-01-2024-10-19-51.jpg)



_-02-01-2024-11-57-38.jpg)











_-27-12-2023-12-39-56.jpg)

.png)



